ਨਾਈਟ੍ਰੇਟ ਅਤੇ ਨਾਈਟ੍ਰਾਈਟ ਦੇ ਵਿਚਕਾਰ ਅਹਿਮ ਅੰਤਰ ਇਹ ਹੈ ਕਿ ਨਾਈਟ੍ਰੋਜਨ ਐਟਮ ਨਾਲ ਬੰਧਨ ਬਣੀਆਂ ਤਿੰਨ ਆਕਸੀਜਨ ਪਰਮਾਣੂ ਦੇ ਨਾਲ ਦੋ ਆਕਸੀਜਨ ਪਰਮਾਣੂ ਹਨ.
ਦੋਨੋ ਨਾਈਟ੍ਰੇਟ ਅਤੇ ਨਾਈਟ੍ਰਾਈਟ ਨਾਰਜਾਨ ਅਤੇ ਆਕਸੀਜਨ ਪਰਮਾਣੂ ਹੁੰਦੇ ਹਨ. ਇਨ੍ਹਾਂ ਦੋਵਾਂ ਅਯੂਰਾਂ ਵਿੱਚ ਇੱਕ -1 ਇਲੈਕਟ੍ਰੀਕਲ ਚਾਰਜ ਹੈ. ਉਹ ਮੁੱਖ ਤੌਰ ਤੇ ਲੂਣ ਦੇ ਮਿਸ਼ਰਣ ਦੇ anion ਹੁੰਦੇ ਹਨ. ਨਾਈਟ੍ਰੇਟ ਅਤੇ ਨਾਈਟ੍ਰਾਈਟ ਦੇ ਵਿਚਕਾਰ ਕੁਝ ਅੰਤਰ ਹਨ; ਅਸੀਂ ਇਸ ਲੇਖ ਵਿਚ ਉਨ੍ਹਾਂ ਅੰਤਰਾਂ ਬਾਰੇ ਵਿਚਾਰ ਕਰਾਂਗੇ.
ਨਾਈਟ੍ਰੇਟ ਕੀ ਹੈ?
ਨਾਈਟ੍ਰੇਟ ਇਕ ਅਪਾਰੰਗਿਕ anian ਹੈ ਜੋ ਰਸਾਇਣਕ ਫਾਰਮੂਲਾ ਨੰਬਰ 3- ਹੈ. ਇਹ ਇਕ ਪੌਲੀਆਟੋਮਿਕ ਅਨੋਇਸ਼ਨ ਹੈ ਜਿਸ ਵਿਚ 4 ਪਰਮਾਣੂ ਹਨ; ਇਕ ਨਾਈਟ੍ਰੋਜਨ ਐਟਮ ਅਤੇ ਤਿੰਨ ਆਕਸੀਜਨ ਪਰਮਾਣੂ. ਐਨੀਅਨ ਦਾ ਸਮੁੱਚਾ ਚਾਰਜ ਹੈ. ਇਸ ਹਰਾ ਦਾ ਮੋਲਰ ਪੁੰਜ 62 ਜੀ / ਐਮਓਐਲ ਹੈ. ਨਾਲ ਹੀ, ਇਹ ਐਨੀਅਨ ਇਸ ਦੇ ਵਿਆਹੁਤਾ ਐਸਿਡ ਤੋਂ ਲਿਆ ਗਿਆ ਹੈ; ਨਾਈਟ੍ਰਿਕ ਐਸਿਡ ਜਾਂ HNO3. ਦੂਜੇ ਸ਼ਬਦਾਂ ਵਿਚ, ਨਾਈਟ੍ਰੇਟ ਨਾਈਟ੍ਰਿਕ ਐਸਿਡ ਦਾ ਸੰਜੋਗ ਅਧਾਰ ਹੈ.
ਸੰਖੇਪ ਵਿੱਚ, ਨਾਈਟ੍ਰੇਟ ਆਇਨ ਦਾ ਕੇਂਦਰ ਵਿੱਚ ਇੱਕ ਨਾਈਟ੍ਰੋਜਨ ਐਟਮ ਹੈ ਜੋ ਕੋਵੈਲਟੀ ਕੈਮੀਕਲ ਬੰਧਨ ਦੁਆਰਾ ਤਿੰਨ ਆਕਸੀਜਨ ਪਰਮਾਣੂ ਦੇ ਨਾਲ ਬੰਨ੍ਹਦਾ ਹੈ. ਜਦੋਂ ਇਸ ਖੁਸ਼ੀਆਂ ਦੇ ਰਸਾਇਣਕ structure ਾਂਚੇ ਨੂੰ ਧਿਆਨ ਵਿੱਚ ਰੱਖਦੇ ਹੋਏ, ਇਸ ਦੇ ਤਿੰਨ ਸਮਾਨ ਬੰਧਨ ਹੁੰਦੇ ਹਨ (ਅਨੀਅਨ ਗਲੋਜ਼ ਦੇ ਗੱਡੀਆਂ ਦੇ structures ਾਂਚਿਆਂ ਦੇ ਅਨੁਸਾਰ). ਇਸ ਲਈ, ਅਣੂ ਦੀ ਜਿਓਮੈਟਰੀ ਟ੍ਰਿਗਰਲ ਪਲਾਨਅਰ ਹੈ. ਹਰੇਕ ਆਕਸੀਜਨ ਪਰਮਾਣੂ ਏ - 2/3 ਚਾਰਜ ਰੱਖਦਾ ਹੈ, ਜੋ ਕਿ ਐਨਿਅਨ ਦੇ ਸਮੁੱਚੇ ਚਾਰਜ -1 ਦੇ ਸਮੁੱਚੇ ਚਾਰਜ ਦਿੰਦਾ ਹੈ.
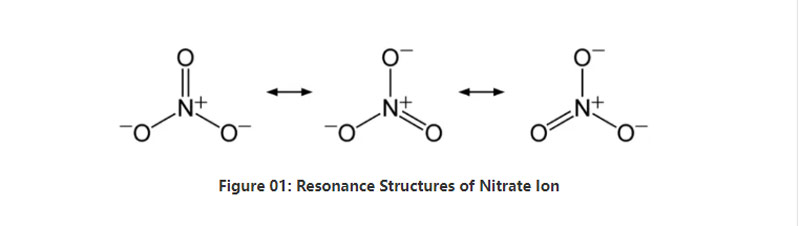
ਸਟੈਂਡਰਡ ਪ੍ਰੈਸ਼ਰ ਅਤੇ ਤਾਪਮਾਨ ਤੇ, ਇਸ ਅੰਭ ਰੱਖਣ ਵਾਲੇ ਲਗਭਗ ਸਾਰੇ ਲੂਣ ਮਿਸ਼ਰਣ ਪਾਣੀ ਵਿੱਚ ਭੰਗ ਕਰਦੇ ਹਨ. ਅਸੀਂ ਧਰਤੀ ਉੱਤੇ ਕੁਦਰਤੀ ਤੌਰ ਤੇ ਨਿਤਰਾਤਾ ਦੇ ਲੂਣ ਨੂੰ ਜਮ੍ਹਾ ਕਰਾਉਣ ਲਈ ਪਾ ਸਕਦੇ ਹਾਂ; ਨਾਈਟਰਤਾਈਨ ਡਿਪਾਜ਼ਿਟ. ਇਸ ਵਿਚ ਮੁੱਖ ਤੌਰ 'ਤੇ ਸੋਡੀਅਮ ਨਾਈਟ੍ਰੇਟ ਹੁੰਦਾ ਹੈ. ਇਸ ਤੋਂ ਇਲਾਵਾ, ਬੈਕਟਰੀਆ ਨਾਈਟ੍ਰੇਟਾਈ ਕਰਨ ਵਾਲੇ ਨਾਈਟ੍ਰੇਟ ਆਇਨ ਪੈਦਾ ਕਰ ਸਕਦੇ ਹਨ. ਨਾਈਟ੍ਰੇਟ ਲੂਣ ਦੀ ਇੱਕ ਪ੍ਰਮੁੱਖ ਵਰਤੋਂ ਖਾਦ ਦੇ ਉਤਪਾਦਨ ਵਿੱਚ ਹੈ. ਇਸ ਤੋਂ ਇਲਾਵਾ, ਇਹ ਵਿਸਫੋਟਕਾਂ ਵਿੱਚ ਆਕਸੀਡਾਈਜ਼ਿੰਗ ਏਜੰਟ ਦੇ ਰੂਪ ਵਿੱਚ ਲਾਭਦਾਇਕ ਹੈ.
ਨਾਈਟ੍ਰਾਈਟ ਕੀ ਹੈ?
ਨਾਈਟ੍ਰਾਈਟ ਇਕ ਅਪਾਰਗੰਕ ਲੂਣ ਹੈ ਜਿਸ ਵਿਚ ਰਸਾਇਣਕ ਫਾਰਮੂਲਾ ਨੰਬਰ 2-. ਇਹ ਐਨੀਅਨ ਇਕ ਸਮਰੂਪ ਅਨੂਰ ਹੈ, ਅਤੇ ਇਸ ਵਿਚ ਇਕ ਨਾਈਟ੍ਰੋਜਨ ਐਟਮ ਹੈ ਜੋ ਦੋ ਆਕਸੀਜਨ ਪਰਮਾਣੂਆਂ ਨਾਲ ਬੰਧਨ ਹੈ ਜਿਸ ਵਿਚ ਦੋ ਸਮਾਨ ਪਰਮਾਣੂ ਰਸਾਇਣਕ ਬੰਧਨ ਹਨ. ਇਸ ਲਈ, ਨਾਈਟ੍ਰੋਜਨ ਐਟਮ ਅਣੂ ਦੇ ਕੇਂਦਰ ਵਿਚ ਹੈ. ਐਨੀਅਨ ਦਾ ਸਮੁੱਚਾ ਚਾਰਜ ਹੈ.
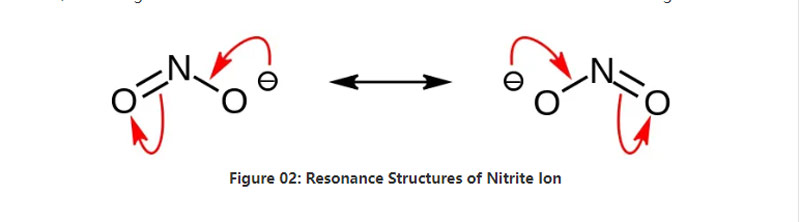
ਐਨੀਅਨ ਦਾ ਮੋਲਰ ਪੁੰਜ 46.01 g / mol ਹੈ. ਨਾਲ ਹੀ, ਇਹ ਐਨੀਅਨ ਨਾਈਟ੍ਰਸ ਐਸਿਡ ਜਾਂ ਐਚ ਐਨ ਐਨ ਐਨ ਐਨ ਐਨ ਤੋਂ ਲਿਆ ਗਿਆ ਹੈ. ਇਸ ਲਈ, ਇਹ ਨਾਈਟ੍ਰਸ ਐਸਿਡ ਦਾ ਸੰਜੋਗ ਅਧਾਰ ਹੈ. ਇਸ ਲਈ, ਅਸੀਂ ਨਾਈਟ੍ਰਾਈਟ ਸਲੈਟਸ ਨੂੰ ਅੰਦਰੂਨੀ ਤੌਰ 'ਤੇ ਲੰਘ ਰਹੇ ਸੋਡੀਅਮ ਹਾਈਡ੍ਰੋਕਸਾਈਡ ਹੱਲ ਵਿੱਚ ਉਦਯੋਗਿਕ ਤੌਰ ਤੇ ਪਹੁੰਚ ਸਕਦੇ ਹਾਂ. ਇਸ ਤੋਂ ਇਲਾਵਾ, ਇਹ ਸੋਡੀਅਮ ਨਾਈਟ੍ਰਾਈਟ ਤਿਆਰ ਕਰਦਾ ਹੈ ਜਿਸ ਨੂੰ ਅਸੀਂ ਰੀਸਾਈਜ਼ਸਟੋਲਾਈਜ਼ੇਸ਼ਨ ਦੁਆਰਾ ਸ਼ੁੱਧ ਕਰ ਸਕਦੇ ਹਾਂ. ਇਸ ਤੋਂ ਇਲਾਵਾ, ਨਾਈਟ੍ਰਾਈਟ ਲੂਣ ਜਿਵੇਂ ਸੋਡੀਅਮ ਨਾਈਟ੍ਰਾਈਟ ਭੋਜਨ ਦੀ ਸੰਭਾਲ ਵਿਚ ਲਾਭਦਾਇਕ ਹੁੰਦੇ ਹਨ ਕਿਉਂਕਿ ਇਹ ਭੋਜਨ ਨੂੰ ਮਾਈਕਰੋਬਾਇਲ ਵਿਕਾਸ ਤੋਂ ਰੋਕ ਸਕਦਾ ਹੈ.
ਨਾਈਟ੍ਰੇਟ ਅਤੇ ਨਾਈਟ੍ਰਾਈਟ ਵਿਚ ਕੀ ਅੰਤਰ ਹੈ?
ਨਾਈਟ੍ਰੇਟ ਇਕ ਵਿਨਾਸ਼ਕਾਰੀ an ਿੱਲ ਹੈ ਜੋ ਰਸਾਇਣਕ ਫਾਰਮੂਲਾ ਨੰਬਰ ਸੀ- ਜਦੋਂ ਕਿ ਨਾਈਟ੍ਰਾਈਟ ਇਕ ਅਪਰਾਧਿਕ ਲੂਣ ਹੈ ਜਿਸ ਵਿਚ ਰਸਾਇਣਕ ਫਾਰਮੂਲਾ ਨੰਬਰ 2-. ਇਸ ਲਈ, ਨਾਈਟ੍ਰੇਟ ਅਤੇ ਨਾਈਟ੍ਰਾਈਟ ਦੇ ਵਿਚਕਾਰ ਪ੍ਰਾਈਮ ਐਰੀਆਂ ਦੇ ਰਸਾਇਣਕ ਬਣਤਰਾਂ ਦੇ ਦੌਰਾਨ ਮੁੱ primary ਲਾ ਹੈ. ਇਹ ਹੈ; ਨਾਈਟ੍ਰੇਟ ਅਤੇ ਨਾਈਟ੍ਰਾਈਟ ਦੇ ਵਿਚਕਾਰ ਅਹਿਮ ਅੰਤਰ ਇਹ ਹੈ ਕਿ ਨਾਈਟ੍ਰੋਜਨ ਐਟਮ ਨਾਲ ਬੰਧਨ ਬਣੀਆਂ ਤਿੰਨ ਆਕਸੀਜਨ ਪਰਮਾਣੂ ਦੇ ਨਾਲ ਦੋ ਆਕਸੀਜਨ ਪਰਮਾਣੂ ਹਨ. ਇਸ ਤੋਂ ਇਲਾਵਾ, ਨਾਈਟ੍ਰੇਟ ਆਨੀ ਇਸ ਦੇ ਵਿਆਹੁਤਾ ਐਸਿਡ ਤੋਂ ਪ੍ਰਾਪਤ ਹੁੰਦਾ ਹੈ; ਨਾਈਟ੍ਰਾਇਕ ਐਸਿਡ, ਜਦੋਂ ਕਿ ਨਾਈਟ੍ਰਾਈਟ ਆਇਨ ਨਾਈਟ੍ਰਸ ਐਸਿਡ ਤੋਂ ਲਿਆ ਜਾਂਦਾ ਹੈ. ਨਾਈਟ੍ਰੇਟ ਅਤੇ ਨਾਈਟ੍ਰਾਈਟ ਆਇਨਾਂ ਦੇ ਵਿਚਕਾਰ ਇਕ ਹੋਰ ਮਹੱਤਵਪੂਰਣ ਅੰਤਰ ਦੇ ਤੌਰ ਤੇ, ਅਸੀਂ ਕਹਿ ਸਕਦੇ ਹਾਂ ਕਿ ਨਾਈਟ੍ਰੇਟ ਇਕ ਆਕਸੀਡਾਈਜ਼ਿੰਗ ਏਜੰਟ ਹੈ ਕਿਉਂਕਿ ਨਾਈਟ੍ਰਾਈਟ ਦੋਵਾਂ ਨੂੰ ਆਕਸੀਡਾਈਜ਼ਿੰਗ ਅਤੇ ਏਜੰਟ ਨੂੰ ਘਟਾ ਸਕਦਾ ਹੈ.
ਪੋਸਟ ਟਾਈਮ: ਮਈ -16-2022





